诱导多能干细胞(iPSCs)是通过特定方式将已经分化的体细胞重编程为具有多能性干细胞,它不仅为药物研发开辟了新的途径,还为细胞替代疗法提供了宝贵的细胞资源。
多能干细胞(PSCs)多能干细胞主要来源于囊胚期的内细胞团(ICM)和原肠胚期之前的胚胎,因其具备分化为动物体内任意组织类型的独特能力,而被视为当前细胞培养技术中发育潜能最为卓越的细胞类型。然而,将体细胞诱导为多能干细胞的过程,需经历彻底的表观遗传重编程,这在过去曾被视为一项几乎不可能完成的任务。
Yamanaka四因子,即Oct4、Sox2、Klf4和cMyc(简称OSKM),这组基因不仅在胚胎内细胞团(inner cell mass,简称ICM)中发挥着诱导多能性的作用,还参与调控后续的细胞分化过程。其中,Oct4、Sox2和Klf4(OSK)作为沉默染色质中的关键转录因子,其先导转录活性被iPSC技术所利用,以实现体细胞在体外的多能性恢复。
Oct4的缺失将导致体细胞多能性丧失。Oct4表达下调并不会立即引发多能性丧失,而是促使多能性调控网络趋于稳定,这暗示了Oct4在细胞分化过程中还具有其他重要功能。尽管Oct4一度被认为是iPSC生成中不可或缺的因子,但内源性Sox2的激活却标志着多能性诱导的完成。此外,外源性Oct4的引入反而会导致OSKM与SKM iPSCs发育潜能的下降,这进一步提示我们,深入探究Oct4的功能对于推动iPSC技术的发展至关重要。
在小鼠胚胎发育过程中,细胞命运在四细胞期(4-cell stage)已基本确定,而高水平Sox2的表达以及Sox2/Oct4的长期结合则驱动了内细胞团的形成。小鼠与人类在建立多能性过程中对Oct4的依赖程度存在差异:敲除Oct4的小鼠囊胚仍能发育出Nanog+的内细胞团,而人类OCT4敲除囊胚则无法实现这一点。因此,研发针对非啮齿类动物,特别是人类多能干细胞诱导的有效新策略,已成为当前学界亟待解决的问题。
德国马普所Hans R. Schöler研究团队、明迅生物吴光明博士等团队合作,在顶级学术期刊Cell Stem Cell上发表了一篇题为《Highly cooperative chimeric super-SOX: Inducing naive pluripotency beyond species boundaries》的研究文章,深入探讨了上述主题,明迅生物吴光明博士合作并进行了详细的分析。

在多能干细胞内部,Oct4与Sox2携手合作,共同调控众多靶标基因。它们之间的协同作用主要通过DNA结合结构域的蛋白质-蛋白质相互作用以及DNA的构象变化来实现。在细胞重编程的起始阶段,若原始位点难以接近,Oct4和Sox2通常会各自独立地结合到DNA上;然而,当两者共同作用于同一位点时,该位点被打开的可能性大大增加。特别是,Sox2与Oct4形成的异二聚体,特别是在典型的HoxB1样SoxOct基序上,对于多能性的诱导和维持至关重要。
除了Sox2,Sox17也能与Oct4合作,但它主要通过结合压缩的SoxOct基序来控制原始内胚层和生殖细胞的命运。有研究表明,通过单个氨基酸残基的交换(Sox17E57K),Sox17的结合偏好可以转向典型的SoxOct,从而使其成为一种多能性诱导剂。此外,较大且活性更强的Sox17 C端转录激活结构域能够增强Sox2的功能。

在这项研究中,作者发现,在重编程混合物中用Sox17E57K替换Sox2后,Oct4突变体能够重新获得生成诱导多能干细胞(iPSC)的能力。随后,作者通过排列组合Sox2和Sox17的结构元素,生成了一系列嵌合的Sox2-Sox17转录因子,并确定了Sox17结构元素中负责这一显著表型的部分,进而构建了一个嵌合的超级SOX因子——Sox2-17。作者进一步在小鼠、人类、猕猴、牛和猪等五种物种中验证了Sox2-17能够显著增强iPSC的生成能力。
此外,作者还在Sox2和Oct4的相互作用界面上进行了氨基酸替换(A61V),通过稳定Sox2/Oct4在DNA上的二聚化,实现了功能的增强。这一改变使得能够生成高质量的OSKM iPSCs,这些细胞能够支持健康全iPSC小鼠的发育。其中iPSC小鼠由明迅生物提供。
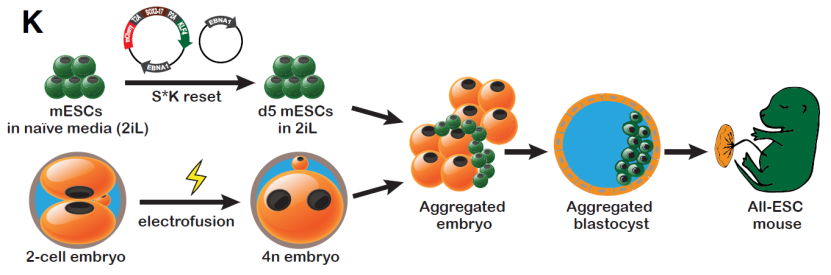
Schematic representation of 4N-complementation experiment with S*K-reset mESCs
小鼠正常2细胞期胚胎(二倍体)经过电脉冲可融合形成四倍体胚胎,四倍体胚胎具有发育缺陷,只能发育形成胚体以外的组织结构,如胎盘、脐带等,而胚胎干细胞(Embryonic Stem Cells, ESCs)能够分化形成体内所有的细胞类型,但是由于自发分化能力的问题,胚胎干细胞无法分化形成胎盘。将胚胎干细胞和四倍体胚胎聚合形成新的重构胚,其中四倍体细胞只参与胚外组织(如胎盘等)而不参与其胚体的形成,而胚体则完全来源于二倍体胚胎干细胞,其可发育成完整小鼠个体,此即为四倍体补偿技术。
目前,使用CRISPR/Cas9等基因编辑技术,人们可以在胚胎干细胞实现几乎任何目标基因位点的编辑,进行基因插入、基因敲除、点突变、人源化等操作,结合四倍体补偿技术后即可从干细胞直接批量制造出目标基因型的纯合子实验小鼠,节省了小鼠繁殖、筛选所需要的大量时间,人力和物力。
四倍体补偿技术发明于20多年前,但它的成功效率始终非常低,仅在国内外少数顶尖实验室可开展,除吴光明研究员团队外,其余已有报道的小鼠出生率仅有1-5%,仅能用于实验室科研,而基因编辑小鼠是小鼠分子生物学研究,创新药物及疫苗研发的重要工具,因此它的高效制作国内外都有巨大需求。
吴光明研究员团队独有的高效四倍体补偿技术方案,可将小鼠的出生率大幅提高至30-60%,解决了四倍体补偿技术的产业化应用瓶颈,可以从小鼠胚胎干细胞直接批量制备基因编辑目标小鼠,绕开常规技术耗时的繁育与筛选步骤,造模周期大大缩短。
该技术的产业化可为全球高校、科研院所、医院、制药企业等生命健康相关科研团队提供高速度、高效率,高质量的各类遗传修饰模式小鼠的定制服务,造模周期在全球范围内具有领先优势,可大大助力我国的疫苗研发、新药研发、精准医疗、紧急卫生事件科研攻关等项目,并为疾病研究中对复杂动物模型的需求提供了快速制备的可能,有望显著推动生命科学领域相关研究进展。
参考资料:
[1]MacCarthy CM, Wu G, Malik V, Menuchin-Lasowski Y, Velychko T, Keshet G, Fan R, Bedzhov I, Church GM, Jauch R, Cojocaru V, Schöler HR, Velychko S. Highly cooperative chimeric super-SOX induces naive pluripotency across species. Cell Stem Cell. 2024 Jan 4;31(1):127-147.e9. doi: 10.1016/j.stem.2023.11.010IF: 19.8 Q1 . Epub 2023 Dec 22. PMID: 38141611.
[2]Tokoro Mikiko., Fukunaga Noritaka., Yamanaka Kaori., Itoi Fumiaki., Terashita Yukari., Kamada Yuko., Wakayama Sayaka., Asada Yoshimasa., Wakayama Teruhiko.(2015). A Simple Method for Transportation of Mouse Embryos Using Microtubes and a Warm Box. PLoS One, 10(9), e0138854. doi:10.1371/journal.pone.0138854
[3]Sarvari Ali., Naderi Mohammad Mehdi., Sadeghi Mohammad Reza., Akhondi Mohammad Mehdi.(2013). A technique for facile and precise transfer of mouse embryos. Avicenna J Med Biotechnol, 5(1), 62-5.
[4]Boland Michael J., Hazen Jennifer L., Nazor Kristopher L., Rodriguez Alberto R., Gifford Wesley., Martin Greg., Kupriyanov Sergey., Baldwin Kristin K.(2009). Adult mice generated from induced pluripotent stem cells. Nature, 461(7260), 91-4. doi:10.1038/nature08310
[5]Zhao Xiao-yang., Li Wei., Lv Zhuo., Liu Lei., Tong Man., Hai Tang., Hao Jie., Guo Chang-long., Ma Qing-wen., Wang Liu., Zeng Fanyi., Zhou Qi.(2009). iPS cells produce viable mice through tetraploid complementation. Nature, 461(7260), 86-90. doi:10.1038/nature08267
特别声明:本文来自明迅生物公众号,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在公众号后台留言联系我们。其他合作需求,请联系sales@mingceler.com。
免责声明:部分素材源于网络,如有侵权,联系删除,本文仅作信息交流之目的,文中观点不代表明迅生物立场,亦不代表明迅生物支持或反对文中观点。

 会员中心
会员中心 EN
EN

 2025.08.21.
2025.08.21.

